Le VENTRICULE UNIQUE
Définition et fréquence
Le terme "ventricule unique" regroupe en réalité un grand nombre de malformations cardiaques différentes mais
qui ont en commun le fait que un des deux ventricules ne s'est pas ou insuffisamment développé et ne pourra donc
pas être utilisé pour le fonctionnement du coeur. Il n'est pas possible de remplacer ou de "refaire" le ventricule
manquant. Dans ce type de malformation cardiaque, le coeur ne peut pas être complètement réparé mais on peut
"arranger" la circulation pour permettre la survie de l'enfant après la naissance. Le ventricule existant sera utilisé
pour pomper le sang vers le corps. L'apport de sang aux poumons, qui est normalement assuré par le ventricule
droit, devra se faire de façon détournée.
La fréquence des malformations de type ventricule unique est difficile à déterminer car ce groupe reprend un
grand nombre de malformations différentes. On peut estimer cependant qu'il représente moins de 10 % de l'ensemble
des malformations cardiaques congénitales. Rappelons que 1 enfant sur 100 naît avec une malformation cardiaque.
Moins de 1 enfant sur 1 000 naît donc avec un "ventricule unique".
Description anatomique
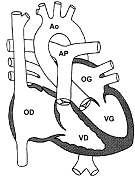
Pour rappel, la figure 1 montre le coeur normal et la légende détaille son fonctionnement. Le circuit "droit" ou bleu
fonctionne indépendamment, en "série" par rapport au circuit gauche ou "rouge".
figure 1 : la partie "droite" du coeur (gauche de l'image) comporte l'oreillette droite (OD) et le ventricule droit (VD), qui éjecte le sang
désoxygéné (bleu) via les artères pulmonaires (AP) dans les poumons. La partie gauche du coeur (à droite de l'image) comporte l'oreillette
gauche (OG), et le ventricule gauche qui éjecte le sang oxygéné (rouge) dans l'aorte (aorte). Ces 4 cavités sont séparées par des cloisons
(septum interauriculaire et septum interventriculaire) et par des valves (valve tricuspide à droite et valve mitrale à gauche).
Pour une meilleure compréhension de ce qui va suivre, il est utile de rappeler que pendant la vie foetale, c'est-à-dire quand l'enfant
est encore dans le ventre de sa mère, la circulation est différente car les poumons ne fonctionnent pas. Cette circulation différente
nécessite 2 communications entre le coeur gauche et le coeur droit : 1) le foramen ovale ; petite communication entre l'oreillette droite et
gauche, 2) le canal artériel ; petite artère reliant l'aorte et l'artère pulmonaire. Ces 2 communications se ferment normalement après la
naissance. Ceci explique pourquoi les foetus peuvent vivre et se développer sans aucun soucis même avec une malformation cardiaque de type
ventricule unique et que les problèmes de circulation n'apparaissent que après la naissance lors de la fermeture naturelle de ces communications.
Ces figures et légendes suivantes montrent quelques exemples de malformations cardiaques de type "ventricule unique", parmi les plus fréquentes.
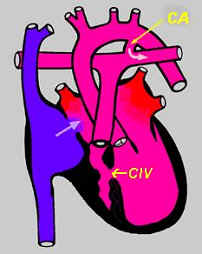
1 - l'atrésie tricuspide
figure 2 : la valve tricuspide et le ventricule droit ne se sont pas développés. Le sang bleu doit donc obligatoirement passer de l'oreillette
droite dans l'oreillette gauche où il se mélange au sang rouge venant des poumons. Ce sang mélangé passe dans le ventricule gauche qui devra
éjecter aussi bien dans l'aorte que dans l'artère pulmonaire, par exemple via une communication interventriculaire (CIV) et/ou par le canal
artériel (CA) resté ouvert. Cette malformation peut être associée à d'autres malformations, comme par exemple une "transposition des grands vaisseaux",
c'est-à-dire que l'aorte naît du petit ventricule droit et l'artère pulmonaire naît du ventricule gauche. Dans ces cas, l'aorte sera souvent
plus petite et cela s'accompagne souvent d'une coarctation (c'est-à-dire rétrécissement au niveau de l'aorte, dans sa partie descendante).
2 - le ventricule gauche à double entrée
figure 3 : dans ce cas, les valves tricuspide et mitrale sont toutes les deux orientées vers le ventricule gauche. Le ventricule droit, souvent
situé à gauche comme montré dans le dessin, est très peu stimulé par ce fait et ne grandira pas. La transposition des grands vaisseaux est souvent
associée (mais pas toujours), comme le montre le dessin : l'aorte naît du petit ventricule droit, l'artère pulmonaire naît du grand ventricule
gauche. D'autres malformations peuvent être présentes comme une sténose pulmonaire, une coarctation, des anomalies des veines pulmonaires ...
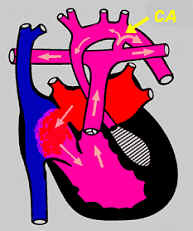
3 - l'hypoplasie du coeur gauche
figure 4 : dans ces cas, toute la partie "gauche" du coeur ne s'est pas ou mal développée : la valve mitrale, le ventricule gauche, l'aorte. Dans ce
cas ci, le sang se mélangera dans le ventricule droit qui, lui, devra faire l'entièreté du travail : éjecter le sang vers l'artère pulmonaire mais
également vers l'aorte, et ce grâce au canal artériel (CA). Ceci constitue évidemment pour le ventricule droit une importante surcharge de travail.
Ici aussi, il peut y avoir d'autres lésions associées comme une coarctation, une anomalie du retour veineux pulmonaire ...
Ceci n'est pas une liste exhaustive car beaucoup d'autres malformations cardiaques existent rentrants dans le groupe des "ventricules uniques". Il est
cependant impossible de toutes les décrire. La présentation clinique, la prise en charge et le pronostic varient d'une malformation à l'autre mais il
existe néanmoins des grandes "similitudes" entre ces différentes malformations. Ceci nous permet donc de vous donner une description assez "générale"
de comment un enfant se présentera, comment il sera pris en charge et ce que l'on peut espérer pour son avenir.
La période néonatale
1. Le diagnostic
Dans un certain nombre de cas, la malformation aura été mise en évidence pendant la grossesse, ce qui permettra alors à la maman d'accoucher dans un
centre spécialisé qui pourra immédiatement prendre en charge l'enfant.
Mais même si l'échographie du foetus est de plus en plus "sophistiquée", il n'est pas toujours aisé de diagnostiquer un "ventricule unique" et beaucoup
d'enfants naissent encore ce jour sans que le diagnostic n'ait été posé pendant la grossesse.
Même sans diagnostic avant la naissance, la suspicion d'une malformation cardiaque se fera, dans la plupart des cas, rapidement après la naissance. En
effet, un examen attentif permettra le plus souvent de remarquer que l'enfant est bleu ou "cyanosé", car le sang bleu et le sang rouge se mélangent. On
pourra parfois, si un rétrécissement au niveau de l'artère pulmonaire ou de l'aorte est associé, ausculter un souffle cardiaque. Ces signes peuvent
cependant être très discrets.
Si la présence du canal artériel est indispensable à une bonne circulation, comme montré ci-dessus dans certains cas d'atrésie tricuspide ou en cas
d'hypoplasie du coeur gauche, la fermeture spontanée du canal artériel à quelques heures ou jours de vie entraînera une dégradation importante de l'état
clinique de l'enfant. Il deviendra soit très bleu car le sang ne parviendra plus aux poumons, ou très pâle-gris et d'aspect malade car le sang ne perfusera
plus correctement les différents organes. Les médecins devront alors réagir rapidement. Dans les autres cas où le canal artériel n'est pas indispensable,
comme par exemple le cas de ventricule gauche à double entrée montré ci-dessus, il peut se passer plusieurs jours, voire semaines, avant que des symptômes
apparaissent comme un essoufflement au biberon ou "dyspnée", une respiration rapide ou "polypnée", des difficultés alimentaires, etc...
2. La prise en charge
Prise en charge immédiate à la naissance
La première chose que le pédiatre devra déterminer sera si la présence du canal artériel est indispensable pour l'enfant. S'il le suspecte, il commencera
sans tarder l'administration d'un médicament par voie intraveineuse, appelé Prostin®. Ce médicament permettra de maintenir le canal artériel perméable et
permettra de transférer en toute sécurité l'enfant vers un centre de cardiologie pédiatrique. En fonction de l'état de l'enfant au moment du diagnostic, il
sera parfois nécessaire d'aider l'enfant en le mettant au respirateur.
Le diagnostic sera ensuite précisé grâce à l'échocardiographie. Cette échocardiographie permettra aussi de confirmer si l'enfant a besoin du canal artériel ou
non. Elle permettra également de voir si la bonne circulation nécessite une large communication entre les oreillettes. C'est le cas par exemple de l'atrésie
tricuspide décrite ci-dessus. Tout le sang bleu doit passer de l'oreillette droite vers la gauche. Il faut donc une large communication entre les deux oreillettes
(CIA). Si l'enfant naît avec une petite CIA, les médecins devront réaliser une "septostomie au ballonnet" encore appelée septostomie selon Rashkind, d'après
le médecin ayant décrit pour la première fois cette procédure. Ceci consiste à introduire un petit cathéter muni d'un ballon via la veine fémorale (veine localisée sous
la peau, au niveau de l'aine) ou via la veine ombilicale (veine présente dans le cordon chez le nouveau-né) vers le coeur. Le ballon, une fois gonflé, permettra de
déchirer la paroi entre les oreillettes et ainsi d'agrandir la communication existante dans cette paroi. Une fois la communication bien agrandie, le ballon est
évidemment retiré. D'autres examens seront en général également nécessaires (prise de sang, ECG, radiographie du thorax) afin de compléter la mise au point.
L'ouverture du canal artériel par le Prostin® et/ou l'agrandissement de la CIA permettront donc en général d'arriver à une situation équilibrée de manière transitoire.
Rappelons que certains enfants n'ont besoin ni de l'un ni de l'autre. La plupart des enfants auront ensuite besoin d'une intervention chirurgicale dans les premières
semaines de vie.
Prise en charge après la stabilisation initiale
Rappelons que dans ce type de malformation, il n'est pas possible de réparer complètement le coeur et qu'il sera nécessaire de dévier la circulation.
Le but final est de séparer le sang bleu et rouge complètement et de faire en sorte que le ventricule existant éjecte uniquement le sang rouge vers le corps
et que le sang bleu aille vers les poumons de manière détournée sans être pompé par le coeur. Ceci ne peut pas se faire en une opération. Il y a en général
2 ou 3 étapes.
1. Les nouveaux-nés nécessitent souvent une première intervention dont le but est d'équilibrer le passage du sang vers le corps et les poumons
2. La 2ème opération est le "Haller" (voir chapitre suivant)
3. La 3ème opération est le "Fontan" (voir chapitre suivant)
La première étape
Reprenons nos exemples d'avant. En cas d'atrésie tricuspide avec nécessité de canal artériel perméable pour perfuser les poumons, le Prostin® ne peut être continué
indéfiniment (médicament intraveineux) ! Le chirurgien placera donc un petit tuyau en Goretex entre l'aorte et l'artère pulmonaire encore appelé "shunt de Blalock"
d'après le chirurgien ayant décrit cette procédure. Ceci vous est montré dans la figure 5. En cas de ventricule gauche à double entrée, ni le Prostin, ni la septostomie
au ballonnet ne seront nécessaires. Par contre au bout de quelques semaines, trop de sang ira vers les poumons car il n'y a aucun obstacle. L'enfant présentera de la dyspnée,
polypnée et des difficultés alimentaires. Cet excès de sang pourra devenir délétère si il est non contrôlé. Pour cette raison, le chirurgien mettra un petit anneau autour de
l'artère pulmonaire ou "cerclage" (banding en anglais) qui permettra de réduire la quantité de sang allant vers les poumons. Ceci vous est montré dans la figure 6. En cas
d'hypoplasie du coeur gauche, une intervention plus complexe sera nécessaire afin de restaurer l'aorte qui est trop petite dans la plupart des cas, c'est l'intervention de
Norwood. Cette intervention vous est montrée dans la figure 7 (PA = artère pulmonaire).
 figure 5 |
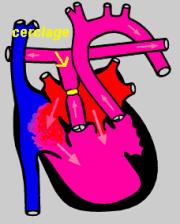 figure 6 |
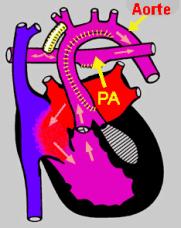 figure 7 |
Les résultats et risques de ces différentes opérations sont très différents en fonction du type de malformation, du type d'opération et de l'état clinique
de l'enfant (le poids par exemple ...). Ceci sera détaillé par le chirurgien ou le cardiologue responsable.
Malgré cette première intervention chirurgicale, l'enfant sera encore cyanosé (bleu) car le sang se mélange encore. Il se peut également que l'enfant soit encore
"polypnéique", facilement essoufflé et qu'il présente des difficultés alimentaires. Ces symptômes sont cependant souvent transitoires. Au bout d'une période de
surveillance post-opératoire en milieu hospitalier (d'abord aux soins intensifs, puis dans le service de cardiologie pédiatrique), l'enfant pourra retourner à
domicile.
La durée de cette période est variable d'un enfant à l'autre mais est en moyenne de 2-3 semaines.
La plupart des enfants nécessiteront des médicaments à domicile : de l'aspirine en cas de shunt de Blalock afin de fluidifier le sang, des diurétiques (médicaments faisant
faire pipi) et du lanoxina ou autres pour soutenir le coeur qui fait plus de travail que d'habitude en raison de la présente d'un seul ventricule, du fer pour éviter
l'anémie etc ... L'enfant sera, après cette première opération, revu fréquemment (minimum 1 fois par mois) en consultation de cardiologie pédiatrique, afin de vérifier
la couleur, la prise pondérale, adapter les médicaments, etc ...
La deuxième étape
Dans la plupart des cas, vers l'âge de 6 mois (parfois un peu avant, parfois après en fonction de l'évolution), une deuxième opération sera programmée. Celle-ci sera grosso modo la
même pour tous, avec toutefois la possibilité de quelques variantes techniques en fonction de l'anatomie cardiaque. Il s'agit de l'intervention selon Haller, encore appelée
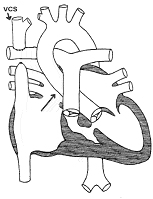
intervention selon Glenn ou anastomose cavo-pulmonaire supérieure bidirectionnelle. Le principe consiste à déconnecter la veine cave supérieure (c'est-à-dire la grosse
veine qui amène le sang bleu de la partie supérieure du corps vers l'oreillette droite) du coeur et de la brancher directement sur les artères pulmonaires. Le sang bleu venant de la
partie supérieure du corps (tête, bras ...) sera donc directement amené vers les poumons sans passer par le coeur via la veine cave supérieure (VCS). La figure 8 vous montre le schéma
de l'intervention.
figure 8 : vous pouvez donc constater que le sang devra s'écouler "passivement" de la veine cave supérieure vers les poumons, en autre mot, il n'y a plus de "pompe" qui propulse le
sang vers les poumons. Afin que cette opération puisse donner des bons résultats et donc que le sang de la tête et des bras s'écoule bien, il faut que les artères pulmonaires soient
de bon diamètre et n'aient pas de rétrécissements sur leur trajet (sténoses). A titre de comparaison, le trafic circule mieux sur de larges autoroutes à 3 bandes où il n'y a pas de
travaux ...
Il sera donc impératif avant la chirurgie de réaliser une bonne échocardiographie mais également un cathétérisme cardiaque pré-opératoire afin de vérifier ces différents aspects. Si les
artères pulmonaires présentent des sténoses, il sera éventuellement proposé de les dilater au moyen d'un ballonnet lors du cathétérisme ou de les élargir lors de la chirurgie. Si les artères
pulmonaires sont trop petites, il faudra parfois faire une autre intervention d'abord dans l'espoir de les faire grandir davantage.
Les risques et complications de la chirurgie seront de nouveau très variables en fonction de ces différents aspects et seront exposés par le chirurgien ou le cardiologue responsable.
Après cette intervention, les enfants seront encore toujours cyanosés (bleus) car, comme vous le montre le dessin, le sang bleu venant de la partie inférieure du corps se mélange toujours dans
le coeur avec le sang rouge. La chirurgie est suivie d'une surveillance post-opératoire d'abord aux soins intensifs puis dans l'unité de cardiologie pédiatrique. Il faut en général minimum
10 jours après l'intervention. Les enfants rentrent le plus souvent à la maison avec quelques médicaments : de l'aspirine pour fluidifier le sang, des diurétiques pour éliminer l'excès d'eau
accumulé en post-opératoire, des inhibiteurs de l'enzyme de conversion (enalapril par exemple (renitec®)) pour soulager un peu le coeur et favoriser la circulation du sang vers les poumons, du
fer pour traiter l'anémie post-opératoire. Les suivis post-opératoires en consultations seront d'abord très rapprochés pour ensuite s'espacer (1 fois tous les 4-6 mois au bout de quelques mois).
La troisième étape
Vers l'âge de 3 à 4 ans, l'intervention de Fontan ou anastomose cavopulmonaire totale sera programmée. Celle-ci consiste à amener le sang bleu de la veine cave inférieure (VCI), drainant
la partie inférieure du corps, directement sur les artères pulmonaires. A ce moment-là, tout le sang bleu drainé par les veines caves arrivera directement dans les artères pulmonaires. La figure 9
vous détaille cette intervention.
figure 9 : plusieurs variantes chirurgicales existent, selon que le chirurgien fasse la connexion à l'intérieur ou à l'extérieur du coeur. Souvent le chirurgien laisse néanmoins un petit passage
(fenestration (F)), comme montré sur le schéma, entre le montage cavopulmonaire et le coeur, qui sert de "soupape" si par moments le passage du sang vers les poumons est plus difficile (par exemple en
post-opératoire immédiat).
Comme pour la seconde étape, il sera indispensable de réaliser une évaluation complète avec cathétérisme cardiaque au préalable entre autres, pour vérifier que les artères pulmonaires soient toujours de
bon calibre. Que la fonction du coeur et des valves soit bonne, ...
Le cathétérisme met parfois en évidence des petits vaisseaux anormaux ("collatérales") que le corps a formé et qui peuvent être gênants pour le chirurgien. Ceux-ci seront alors obturés ("embolisation"). A
nouveau, si nécessaire, les artères pulmonaires peuvent être dilatées.
Il arrive, rarement heureusement, qu'en raison d'un mauvais aspect des artères pulmonaires (artères trop petites) ou de valves intracardiaques déficientes ou d'une mauvaise fonction du ventricule, il soit
préférable de ne pas réaliser cette opération de Fontan, car celle-ci ne donnerait alors pas de bons résultats. Les autres options devront alors être rediscutées.
L'intervention de Fontan présente, comme les autres interventions, des risques et des complications qui seront expliquées par le chirurgien ou le cardiologue pédiatre responsable.
Après cette intervention, les enfants ne seront en général plus cyanosés ou très peu, sauf si beaucoup de sang passe en permanence par la fenestration. La chirurgie est suivie d'une surveillance
post-opératoire d'abord aux soins intensifs puis dans l'unité de cardiologie pédiatrique. Il faut en général minimum 10 jours après l'intervention. Les enfants rentrent le plus souvent à la maison avec
quelques médicaments : de l'aspirine pour fluidifier le sang, des diurétiques pour éliminer l'excès d'eau accumulé en post-opératoire, des inhibiteurs de l'enzyme de conversion (enalapril par exemple (renitec®))
pour soulager un peu le coeur et favoriser la circulation du sang vers les poumons. Les suivis post-opératoires en consultations seront d'abord très rapprochés pour ensuite s'espacer (1 fois tous les 6-12 mois
au bout de quelques mois). L'aspirine sera, en général, poursuivi à long terme.
Dans un certain nombre de cas, l'enfant sera re-cathétérisé après l'opération de Fontan pour soit fermer la fenestration, soit à nouveau emboliser (obturer) des collatérales (voir ci-dessus).
Quel est l'avenir ?
Lorsqu'un ventricule est absent ou mal développé, la chirurgie actuelle ne peut malheureusement pas le "réinventer".
Autrement dit, l'ensemble des interventions décrites ci-dessus sont des interventions "palliatives" et non "curatives". Elles ne construisent pas un coeur normal mais permettent au sang bleu et sang rouge de
circuler séparément, ce qui soulage le ventricule unique.
Ces interventions permettent en général à l'enfant de grandir normalement, de fréquenter l'école, et même de pratiquer du sport. Cependant, il est possible que l'enfant soit moins performant au niveau sportif
qu'un de ses camarades ayant un coeur normal. On peut ainsi comparer un coeur uni-ventriculaire à un "moteur diesel", un coeur normal étant un "moteur essence". L'adaptation à l'effort sera cependant très variable
d'un enfant à l'autre et beaucoup de patients participent régulièrement à des activités sportives à l'école ou même en club extra-scolaire !
Plusieurs femmes, arrivées à l'âge adulte, ont elles-mêmes eu des enfants. Les grossesses doivent cependant être suivies de très près par l'obstétricien mais également par un cardiologue ayant l'habitude de la prise en
charge des patientes avec ventricule unique. La contraception doit être discutée et choisie en accord avec l'obstétricien et le cardiologue. De façon générale, il est capital que ces patients soient revus au moins une
fois pas an par un cardiologue expérimenté.
Avec le temps, en effet, le ventricule "unique" peut montrer des signes de fatigue. Ceci est rare avant l'âge de 20 ans mais dépend une fois de plus du type de malformation cardiaque sous-jacente ainsi que de la prise en
charge effectuée pendant l'enfance. Ceci peut se manifester par une fatigabilité plus importante à l'effort ou par des troubles du rythme cardiaque (palpitations, rythme trop lent ou trop rapide). Les troubles du rythme
nécessitent une prise en charge agressive (médicaments, interventions, mise en place de pacemaker ...) car en absence de traitement, ils peuvent davantage fatiguer le coeur. En cas de "défaillance" prononcée du ventricule
unique ne répondant pas aux médicaments ou à une nouvelle opération, il faudra éventuellement envisager la greffe cardiaque.
(dossier réalisé par le Professeur Caroline Ovaert)